
ISO 13485
Soulad zdravotnických prostředků s předpisy

Soulad zdravotnických prostředků s předpisy

Řízení životního cyklu softwaru

Efektivní řízení rizik

Řešení rizik kybernetické bezpečnosti

Nařízení o zdravotnických prostředcích

Soulad s předpisy a kybernetická bezpečnost

Organizační zabezpečení dat

Systémy umělé inteligence pro zdravotnictví

Soulad s americkými normami

Systémy řízení umělé inteligence

Americké nařízení o systému kvality

Nařízení o diagnostických prostředcích in vitro

Validace počítačových systémů
Nápravná a preventivní opatření

Hodnocení systému kvality

Pomáháme vám implementovat kvalitní a regulativní prostředí pro software vašich zdravotnických prostředků, které je nejen v souladu s předpisy, ale také funguje pro vaši organizaci. Takové řešení bude odrážet vaši filozofii, strukturu a každodenní realitu a propojí lidi, procesy a cíle do jedné funkční jednotky.
Uvědomujeme si, že dodržování předpisů není jedinou prioritou vaší organizace. Máte své obchodní plány, termíny vydání a cíle týmu. Neupřednostňujeme regulační nebo kvalitativní činnosti před ostatními, ale ukazujeme, jak mohou všechna oddělení spolupracovat na dosažení svých cílů v souladu: být rychlá, dodržovat předpisy a být zároveň efektivní.
Provedeme vás konkrétními standardy, ale naším skutečným cílem je pomoci vám pochopit, jak všechny tyto standardy souvisí a fungují jako jeden soudržný systém.
Chápeme, že vaším cílem není pouze dodržování předpisů, ale také úspěch na trhu, zachování inovativnosti, efektivity a rychlosti, abyste předčili konkurenci a zároveň dodávali bezpečné a vysoce kvalitní produkty.
Vzájemné porozumění mezi lidmi a odděleními je zásadní. Věříme, že každý tým ve vaší společnosti dbá na kvalitu; někdy však mají odlišný pohled na to, co kvalita znamená nebo jak ji lze dosáhnout. Pomáháme sladit tyto perspektivy, aby se kvalita stala společným jazykem, nikoli zdrojem třenic.
Pomůžeme vám vytvořit prostředí, které vaši zaměstnanci chápou, kde pracují rychleji, lépe komunikují a těší se z toho, že jsou součástí smysluplného a moderního systému řízení kvality.
QMLogic nabízí kompletní poradenské služby pro životní cyklus softwaru pro zdravotnické prostředky.
Standardy, se kterými pracujeme, tvoří základ pro dodržování předpisů pro každou společnost, která vyvíjí software v regulovaném prostředí zdravotnických prostředků.
V průběhu let jsme podporovali naše klienty v mnoha oblastech, od budování systémů řízení kvality a formování regulačních strategií až po implementaci procesů řízení rizik a kybernetické bezpečnosti a jejich integraci do moderních řešení eQMS.
Díky této práci jsme si vybudovali hluboké odborné znalosti v komplexním ekosystému norem a předpisů pro evropský i americký trh.
To nám umožňuje nabídnout našim klientům komplexní poradenství v oblasti softwaru pro zdravotnické prostředky, které kombinuje regulační i technické perspektivy.

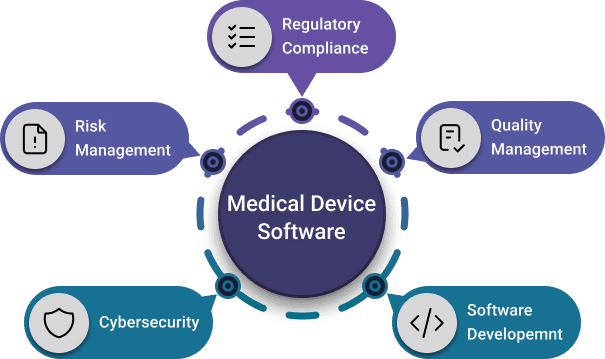
Každá z hlavních norem a předpisů pro zdravotnické prostředky se zabývá konkrétním aspektem stejné reality. Nejedná se o izolované dokumenty; společně definují propojenou síť činností, které pokrývají celý životní cyklus softwaru, od návrhu a vývoje přes údržbu až po sledování účinnosti a bezpečnosti na trhu.
Místo toho, abychom nechali procesy a normy existovat vedle sebe, integrujeme je dohromady a zajišťujeme, aby vaše organizace fungovala jako jeden dobře koordinovaný systém.
Implementujeme normy do praktického rámce přizpůsobeného potřebám vaší organizace.

Kombinujeme znalosti předpisů s praktickým zohledněním toho, jak se vaše organizace vyvíjí, včetně její velikosti, struktury a tempa růstu.
Každá společnost, se kterou spolupracujeme, se nachází v jiné fázi své cesty. Některé budují své první systémy, jiné se po investici rychle rozšiřují a mnoho z nich optimalizuje vyspělá prostředí kvality.
Přizpůsobujeme se vašemu kontextu, velikosti, struktuře a prioritám, abychom navrhli řešení, která pro vás mají smysl nyní a vytvoří základ pro to, kam chcete směřovat v budoucnu.
K dodržování předpisů přistupujeme prakticky. Pro menší týmy to znamená pomoci vám stanovit, co je podstatné a efektivní, bez zbytečné složitosti. Pro větší organizace jde o zvýšení efektivity, vyvarování se nadbytečných činností a plnou integraci dodržování předpisů do složitých firemních operací.
Dodržování předpisů bude postaveno na dynamice vaší organizace.
Naše pozornost se vždy soustředí na propojení: týmy, systémy a sladění obchodních a regulačních cílů. Výsledkem je kvalitní prostředí, které se přirozeně vyvíjí spolu s vaší organizací.
Neomezujeme se pouze na vysvětlení toho, co je třeba udělat, ale pomáháme vám to realizovat
Působíme jako rozšíření vašeho týmu a převádíme regulační požadavky do praktických opatření.
Náš tým vám pomůže:


Od regulačního konceptu po pracovní proces – děláme compliance hmatatelnou.
Naše zapojení pokrývá celý životní cyklus softwaru pro zdravotnické prostředky, od prvního nápadu až po činnosti po uvedení na trh:
Definování klasifikace produktu a cesty k dosažení shody.
Zajištění souladu technické dokumentace a záznamů s normami.
Vytváření robustních souborů a jejich integrace do životního cyklu vašeho produktu.
Podpora nepřetržitého sledování shody a výkonu.
Ať už potřebujete navrhnout, propojit nebo transformovat konkrétní části svého regulačního a compliance prostředí, pomůžeme vám to udělat efektivně a v souladu se všemi příslušnými předpisy, jako jsou ISO 13485, ISO 14971, IEC 62304, MDR 2017/745 a 21 CFR 820.
Zavedení a udržování dodržování předpisů v odvětví softwaru pro zdravotnické prostředky již není možné bez moderního digitálního základu.
Interpretace norem, poradenství a dokonce i implementační úsilí ztrácejí svou dlouhodobou hodnotu, pokud nejsou podporovány účinným elektronickým systémem řízení kvality (eQMS).
Mnoho společností váhá s digitalizací svého QMS, často se obávají, že nástroje nebudou vyhovovat jejich struktuře nebo neprojdou regulačními audity nebo inspekcemi FDA.
Skutečné riziko však nespočívá v transformaci, ale ve stagnaci. Absence správně implementovaného eQMS vede k regulačním nákladům, neefektivitě a rostoucím nákladům na údržbu.
Pomáháme vám:
Věříme, že dlouhodobé dodržování předpisů lze dosáhnout pouze prostřednictvím funkčních a monitorovaných digitálních řešení.
Tyto moderní nástroje QMS zajišťují, že vaše organizace zůstane v souladu s předpisy a zároveň bude agilní, moderní a efektivní.

Váš systém QMS definuje, jak vaše organizace funguje. Napsání procesu je však pouze prvním krokem. Skutečná transformace nastává, když tyto procesy ožívají v moderním digitálním prostředí, které vaši zaměstnanci používají každý den.
Vytvořme společně moderní propojenou infrastrukturu pro vaši organizaci, která hladce podporuje všechny normy a promění váš systém QMS v systém provozní excelence, nikoli pouze dodržování předpisů.
Transformace nastává, když procesy přestanou být popisovány a začnou být žity.
Poskytujeme kompletní poradenské služby v oblasti softwaru pro zdravotnické prostředky a služby implementace souladu, které pokrývají celý proces, od definování vaší regulační strategie a návrhu interních procesů v souladu s předpisy až po implementaci všech relevantních standardů a předpisů v rámci jednoho soudržného, propojeného systému.
Sada standardů a předpisů, se kterými úzce spolupracujeme. Řeší podobné výzvy z různých perspektiv a při společné implementaci se přirozeně vzájemně posilují.
V následujících částech ilustrujeme, jak jsou tyto rámce propojeny, jak dodržování jednoho z nich posiluje vaše souladu s ostatními a proč se zaměřujeme konkrétně na tuto sadu norem.
Následující normy jsou nejrelevantnější pro software pro zdravotnické prostředky a jsou to ty, se kterými se každá organizace setká při budování organizace pro zdravotnické prostředky, která je v souladu s předpisy, bezpečná a moderní.
Vybudovat prostředí, které je v souladu s předpisy, konzistentní a efektivní, bez redundance a zbytečné složitosti.
Ve společnosti QMLogic umožňujeme organizacím revolučním způsobem modernizovat jejich systémy řízení kvality (QMS) pomocí špičkových nástrojů pro digitalizaci a automatizaci. Využitím Jira, Confluence, SharePoint, Power Platform a řešení na míru navrhujeme efektivní, automatizované systémy, které jsou v souladu s ISO 13485 a jsou přizpůsobeny vašim jedinečným potřebám.
Vývoj softwaru pro zdravotnické prostředky
QMLogic poskytuje důvěryhodné regulační poradenské služby pro zdravotnické prostředky a softwarovou podporu pro soulad s předpisy pro zdravotnické prostředky, která vás provede od vývoje až po úspěšnou certifikaci.
Informace
Contact Details